Konventionen und Definitionen der Elektrochemie
Vorraussetzung für die Diskussion der Elektrochemie ist eine eindeutige Nomenklatur, Normierung und Vorzeichendefinition. Im folgenden wird ein weithin anerkanntes System beschrieben. Zum besseren Verständnis ist ein Beispiel einer galvanischen Zelle angefügt.
Elektrodenbezeichnungen
An der Anode findet immer die Oxidation statt, an der Kathode immer die Reduktion.
Eselsbrücke: "Das A und O: An der Anode Oxidation."
Dies gilt für galvanische Elemente und die Elektrolyse gleichermaßen. Unterschiede entstehen dadurch bei der relativen Ladung der Elektroden zueinander:
| |
Galvanisch |
Elektrolyse |
| Anode |
- |
+ |
| Kathode |
+ |
- |
Die Regel "Anionen wandern zur Anode, Kationen zur Kathode (entgegengesetzte Ladungen ziehen sich an)" gilt uneingeschränkt nur für den Fall der Elektrolyse! Bei galvanischen Elementen ist diese Zuordnung nicht mehr ganz so eindeutig. Im Daniell-Element z. B. lagern sich zwar die Kupfer-Kationen an die Kathode an (und werden dabei zum Metall reduziert!) und die Zink-Kationen treten aus der Anode aus (nachdem das Metall oxidiert wurde!), dies kann aber nicht durch die Ladungen erklärt werden, nicht zuletzt da diese erst als Folgeerscheinung entsprechend der Spannungsreihe entstehen. Ähnliches gilt für die zugehörigen Anionen, die sich zwar auch in den Anodenraum bewegen, jedoch primär um die Neutralität der Lösung aufrechtzuerhalten.
Redoxpaare, Elektoden, Zellen, Halb- und Zellreaktionen
Bei der Angabe eines Redoxpaares schreibt man immer zuerst die oxidierte, dann nach einem Schrägstrich die reduzierte Form.
Die reduzierte Form steht immer rechts: "Rechts Reduktion!", z. B. Cu2+/Cu.
Bei Elektroden steht ein senkrechter Trennstrich für eine Phasengrenzfläche und ausnahmsweise meist die reduzierte Form zuerst.
Hier denkt man sich bei der Reihenfolge quasi vom Inneren der Elektrode nach Außen, z. B. bei der Kupfer-Elekrode vom Metall in die ionische Elektrolytlösung oder bei Platin-Gas-Elektroden vom Platin durch das Gas in das umgebende Medium. Bei der Beschreibung von Elektroden kommt es demnach hauptsächlich auf den physikalischen Aufbau an.
Kombiniert man Elektroden zu Zellen, so schreibt man wieder diejenige Halbzelle rechts, in der die Reduktion stattfindet. Die einzelnen Phasen werden in der Reihenfolge ihres Auftretens auf dem gedanklichen Weg vom Inneren der Anode zum Inneren der Kathode durch senkrechte Striche getrennt aufgeführt. Salzbrücken werden durch einen senkrechen Doppelstrich, Membranen durch eine senkrechte Linie aus drei Punkten symbolisiert.
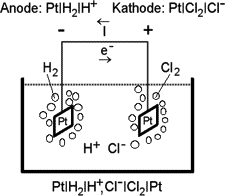
Die Komponenten einer galvanische Zelle aus einer Wasserstoff- und einer Chlorgaselektrode, die in eine gemeinsame Salzsäurelösung tauchen, werden in folgender Reihenfolge durch einen senkrechten Strich getrennt aufgeführt: Platin, Wasserstoffgas, Protonen, Chlorid, Chlorgas, Platin.
Halbreaktionen und ihr Potential werden immer als Reduktion formuliert.
Zellreaktionen und Zellpotentiale ergeben sich durch Subraktion der Reduktionshalbreaktionen und -potentiale der beteiligten Elektroden, indem man die Anodenreaktion (als Reduktion!) von der Kathodenreaktion abzieht.
Das Potential der Normalwasserstoffelektrode (NHE) wird willkürlich gleich 0 Volt gesetzt. Werden Halbreaktionen als Reduktionen formuliert, so erhalten die Potentiale der Edelmetalle ein positives Vorzeichen, die unedlen, stärker reduzierend wirkenden Metalle ein negatives (s. elektrochemische Spannungsreihe).
Daraus lassen sich die Zellreaktionen und Zellspannungen beliebiger Zellen bestimmen, indem man die Reduktions(!)reaktion der Elektrode, die als Anode fungiert, von der der Kathode abzieht. Analog wird für die Zellspannung verfahren. In Übereinstimmung mit den obigen Konventionen rechnet man dadurch rechts minus links.
Man kann mit dieser Methode auch die Zuordnung von Anode und Kathode überprüfen: Ergibt sich für die Potentialdifferenz ein positives Vorzeichen, dann läuft die Zellreaktion spontan ab, d. h. bei der vorliegenden Zuordnung liegt ein galvanisches Element vor. Ist eine Elektrolyse beabsichtigt, muß sich ein negatives Vorzeichen ergeben, d. h. die Reaktion läuft nur erzwungen ab.
Beispiel einer galvanischen Zelle
Reduktionshalbreaktionen
Rechts: Cl2 + 2 e- --> 2 Cl- ; E = +1.36V
- Links: 2 H+ + 2 e- --> H2 ; E = 0V
________________
Cl2 + H2 --> 2 Cl- + 2 H+ ; E = +1.36V
|
 |
Elektrodenreaktionen
Reduktion: Cl2 + 2 e- --> 2 Cl- (Kathode)
+ Oxidation: H2 --> 2 H+ + 2 e- (Anode)
________________
Redox: Cl2 + H2 --> 2 Cl- + 2 H+ (Zelle)
|
Bekannt ist, daß es sich bei der vorliegenden Zelle um zwei Platinelektroden handelt, die einmal von Wasserstoffgas und einmal von Chlorgas umspült werden. Sie tauchen in eine gemeinsame Elektrolytlösung ein, nämlich verdünnte Salzsäure.
Aus diesen physikalischen Gegebenheiten erhält man direkt die Elektrodendiagramme nach beschriebener Nomenklatur (von innen nach außen, senkrechter Strich für Phasengrenze).
Als nächstes formuliert man für jede Elektrode die entsprechende Reduktionsreaktion. Jetzt kann man zunächst entweder raten, welche Elektrode als Anode bzw. Kathode fungiert, oder man wirft bereits einen Blick in die elektrochemische Spannungsreihe: Die Reduktionsreaktion mit dem niedrigeren Potential läuft tatsächlich umgekehrt als Oxidation, die zugehörige Elektrode ist demnach die Anode, an der dadurch festgelegten Kathode bleibt die Reaktion wie gehabt. (Diese Zuordnung gilt für eine galvanische Zelle, bei einer Elektrolyse liegen die Verhältnisse gerade umgekehrt.)
Jetzt kann das Zelldiagramm formuliert werden (Reduktion (Kathode) rechts), dann werden die Gleichungen und die zugehörigen Potentiale (spätestens jetzt braucht man Tabellenwerte) voneinander abgezogen wie links neben der Grafik gezeigt. Man erhält eine Zellreaktion und ein Zellpotential. Ist das Zellpotential negativ, hat man vorher bei der Elektrodenzuordnung falsch geraten oder nicht richtig in die Tabelle geschaut. Die Elektrodenbezeichnungen müssen dann vertauscht und das Zelldiagramm umgedreht werden. (Dies gilt wieder nur, wenn man wie in diesem Fall eine galvanische Zelle bauen wollte, denn eine Reaktion mit negativem Potential läuft nicht freiwillig ab, sondern muß z. B. wie bei der Elektrolyse durch einen elektrischen Strom von außen erzwungen werden).
Hat man das richtige Vorzeichen, lassen sich Anoden- und Kathodenreaktion formulieren (s. o.: Anodenreaktion zur Oxidation umkehren, dadurch Vorzeichenwechsel beim Potential), die addiert die gleiche Zellreaktion und das gleiche Zellpotential ergeben (s. rechts neben der Grafik, Potentiale wie links, da +0V = -0V = 0V beim Wasserstoff).
Der letzte Schritt ist die Ermittlung der Ladung: Entweder man behält die Tabelle am Anfang dieser Seite im Kopf, oder man überlegt sich, daß in einer galvanischen Zelle die bei der Oxidation entstehenden Elektronen eine negative Ladung auf der Anode erzeugen und zur relativ dazu positiven Kathode fließen, um dort bei der Reduktion verbraucht zu werden. Genau umgekehrt ist es wieder bei der Elektrolyse. Der Strom I fließt definitionsgemäß genau andersherum von plus nach minus (historisch bedingte technische Stromrichtung).
« × »
19. Juli 1998 
