2. (wesentlich:) Tautomerie über resonanzstabilisiertes Enolat-Ion zum Enol (mit Katalysator)
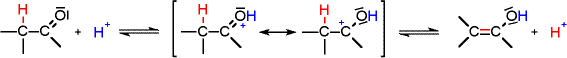
| Nomenklatur: |
| Vorrang vor Hydroxy-, Alkenyl- und Alkinylgruppen |
| CHO-Substituent := Methanoyl oder Formyl, am Ring Carbaldehyd |
| R-CO- := Alkanoyl (auch Acyl) |
| Eigenschaften der Carbonylgruppe: | |
| Carbonyl-Kohlenstoff und -Sauerstoff sind sp2-hybridisiert » planare Geometrie: | |
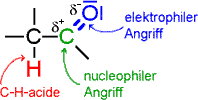
| Carbonyl-Kohlenstoff ist elektrophil durch Resonanz: | |
| -C=O reagiert basisch | |
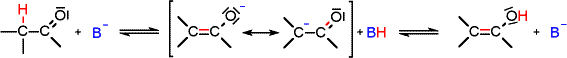
| a-H ist sauer | |
| Grund: | 1. induktiver Effekt des positivierten Carbonyl-Kohlenstoffs 2. (wesentlich:) Tautomerie über resonanzstabilisiertes Enolat-Ion zum Enol (mit Katalysator) |
Säurekatalyse: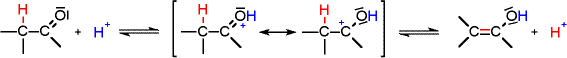 | |
Basenkatalyse: | |
| Siedepunkte entsprechen etwa denen der Halogenalkane | |
| Oxidation von Alkoholen, z. B. CH3OH ---O2, 600-650 °C, Ag---> HCHO; allgemein mit CrO3 ACHTUNG: Überoxidation von primären Alkoholen über Aldehyde zu Carbonsäuren; vermeidbar mit Pyridin in wasserfreiem Medium |
| Oxidative Spaltung von Alkenen, z. B. mit Synthesegas: R-HC=CH2 + H2 + CO ---Druck etc.---> R-CH2-CH2-CHO (neues Kettenglied!) |
| Hydratisierung von Alkinen ---H+, Hg2+---> Enole ---Tautomerisierung---> Carbonylverbindungen Schritt 1 nach Markovnikov! |
| Ozonolyse (Spaltung von Alkenen): >C=C< ---O3, Reduktionsmittel---> 2 >C=O |
| Protonierung erhöht Elektropositivität des Carbonyl-Kohlenstoffs » bessere Addition |
| Hydrierung zu Alkoholen besonders bei elektronenziehenden Substituenten |
| H2O hydratisiert >C=O zum geminalen Diol, säure- oder basenkatalysiert, Hydratanteil fällt bei Elektronenschub |
| Halbacetale: |
| |
| durch Addition von Alkohol an die Carbonylgruppe, Säurekatalyse |
| Gleichgewicht meist bei Carbonylen, bessere Reaktion bei intramolekularer Halbacetalbildung mit 5- oder 6-Ringschluß (Kohlenhydrate!) |
| Acetale: |
| |
| aus Halbacetalen durch nochmalige Addition von Alkohol an resonanzstabilisiertes Oxocarbeniumion, vorher Abspaltung der protonierten Hydroxygruppe (Säurekatalyse) |
| Ketone und kleine (1,2)-Diole geben cyclische Acetale (Schutzgruppe, auch nichtcyclisch) |
| Acetale sind säure-instabil, Gleichgewichtsreaktionen |
| Thiole analog: » Hemithioacetale » Thioacetale | |
| Schwefel ist nucleophiler als Sauerstoff » schnellere Reaktion | |
| relative Stabilität gegenüber verdünnten Säuren | |